Krankheiten einer Katze.
Felines Coronavirus
| Systematik | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||
| Feline coronavirus (engl.) | ||||||||||||||
| Taxon-Kurzbezeichnung | ||||||||||||||
| FECV, FCoV | ||||||||||||||
| Links | ||||||||||||||
|
Das Feline Coronavirus (FCoV) ist ein Katzen (Felis spp.) befallendes Alphacoronavirus (Coronaviridae). Ursprünglich ging man davon aus, dass zwei verschiedene Corona-Viren bei Katzen auftreten.
Die stark virulente Form verursacht die Feline Infektiöse Peritonitis und wurde seit seiner Entdeckung 1968 als Felines Infektiöses Peritonitis-Virus (FIPV) bezeichnet. Dessen Zuordnung zu den Coronaviren ist seit Ende der 1970er Jahre anerkannt.
Ein dem FIPV ähnelndes, aber nur subklinische oder milde Darminfektionen hervorrufendes Virus, wurde 1981 beschrieben. Es wurde zunächst Felines Enterales Coronavirus (FECV) genannt. FECV-Infektionen sind häufig und kommen weltweit vor. Am empfänglichsten sind Katzenwelpen im Alter von sechs bis zwölf Wochen. Die FECV-Infektion zeigt sich in leichten Durchfällen und Erbrechen. Die Behandlung richtet sich auf eine Beseitigung der Austrocknung, meist durch Gabe von ausreichend Flüssigkeit (Isotonische Kochsalzlösung), eventuell Infusionen.
1987 stellte Pedersen die Hypothese auf, dass FECV und FIPV ein Virus darstellen und sich lediglich hinsichtlich ihrer Virulenz unterscheiden. 1998 gelang seiner Arbeitsgruppe der Nachweis, dass das FIPV lediglich eine Mutation des FECV darstellt (Vennema, H. et al.). Ab 2000 setzte sich der Begriff Felines Coronavirus (FCoV) als Erregerbezeichnung durch.
Feline Infektiöse Peritonitis FIP
Die Feline Infektiöse Peritonitis (FIP) ist eine durch das Feline Coronavirus ausgelöste Infektionskrankheit, die ausschließlich Katzen (Felidae) befällt. Der Name leitet sich von der häufigsten klinischen Manifestation, einer Bauchfellentzündung (Peritonitis) ab. Allerdings kann auch lediglich das Brustfell betroffen sein, weshalb selten auch der Name Feline Infektiöse Polyserositis verwendet wird. Außerdem kann ein Krankheitsbild ohne jede Beteiligung der Serosa (Auskleidung der Körperhöhlen) auftreten. Kommt es einmal zu einer klinischen Manifestation der Erkrankung, endet diese in aller Regel tödlich. Die Erkrankung tritt weltweit auf.
Ursache und Epidemiologie
| Felines | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Systematik | ||||||||||||||
|
||||||||||||||
| Taxonomische Merkmale | ||||||||||||||
|
||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||
| Coronaviridae (engl.) | ||||||||||||||
| Taxon-Kurzbezeichnung | ||||||||||||||
| FECV, FCoV | ||||||||||||||
| Links | ||||||||||||||
|
Die Ursache für die FIP ist ein hoch virulentes Coronavirus. Das heute als Felines Coronavirus (FCoV) bezeichnete Virus wurde bis Ende der 1990er Jahre in zwei verschiedene Viren unterteilt: Das wenig pathogene, sogenannte „Feline Enterale Coronavirus“ (FECV) und das stark pathogene „Feline Infektiöse Peritonitis-Virus“ (FIPV). Letzteres ist aber lediglich eine Mutation des „FECV“ innerhalb des Trägertieres. Beide werden gegenwärtig als Subtyp bzw. Isolat der Virusspezies Alphacoronavirus 1 klassifiziert.
Die Mutation besteht aus einer Deletion im viralen Gen 3C, welche allerdings nicht immer an derselben Stelle stattfindet. Begünstigt wird die Veränderung durch das ungenaue Arbeiten der viralen RNA-Polymerase, durch die es bei der Replikation zu einem falsch eingebauten Nukleotid pro 1.000 bis 10.000 Nukleotiden kommt. Bei einer Gesamtlänge der Virus-RNA von etwa 30.000 Nukleotiden sind also bereits drei Mutationen im Erbgut des Virus pro Replikation „normal“.
Das FCoV kommt weltweit vor, aber nur bei etwa fünf bis zehn Prozent der seropositiven (infizierten) Hauskatzen bricht die FIP-Erkrankung aus. Bezogen auf die gesamte Katzenpopulation hat die FIP eine Vorkommenshäufigkeit (Prävalenz) von ein bis zwei Prozent. Es werden serologisch zwei Virustypen unterschieden, wobei der vor allem in Europa und den USA auftretende Typ 1 in Zellkulturen vermehrbar ist, was mit dem vor allem in Japan auftretenden Typ 2 nicht möglich ist.
Die Inkubationszeit beträgt vermutlich bis zu vier Monate. Bereits am zweiten Tag nach der Infektion scheiden die Tiere das Virus über Kot, Nasensekret und Speichel aus. Die Virusausscheidung kann lebenslang anhalten. Die Übertragung des zunächst ungefährlichen Virus erfolgt vor allem durch Kontakt mit infiziertem Kot oder über verunreinigte Gegenstände. Auch eine Maul-zu-Maul- oder Maul-zu-Nase-Übertragung ist möglich.[1] In der Umgebung ist das Virus bis zu eine Woche infektiös.[2] Überdies können Menschen das Virus transportieren und auf die Katze übertragen. Oft infizieren virustragende Katzenmütter ihre Feten bereits während der Trächtigkeit. Die Übertragung der bereits mutierten Form spielt vermutlich keine Rolle bei der Verbreitung der Krankheit.
Prinzipiell sind alle Katzenarten und Altersgruppen für FIP empfänglich. Am häufigsten befällt die Erkrankung Tiere im Alter von sechs Monaten bis fünf Jahren und ältere Tiere ab 14 Jahren. Da wild lebende Katzen meist Einzelgänger ohne feste Kotplätze sind, sind Wildtiere deutlich seltener infiziert. Eingefangene verwilderte Hauskatzen sind zu etwa 10 % seropositiv, nach wenigen Wochen in einem Tierheim dagegen fast 90 % der Tiere. Bei Großkatzen sind ebenfalls besonders größere Bestände in Zoos gefährdet, Leoparden gelten als besonders empfänglich.
Pathogenese und Formen
Die Pathogenese der Erkrankung ist bislang nicht vollständig geklärt. Die Mutation der zunächst harmlosen FCoV-Variante in die sogenannten „FIP-Viren“ erfolgt im Darm und kann Jahre nach der Infektion erfolgen. Mit der Mutation erlangt das Virus die Fähigkeit, sich an Ribosomen der Fresszellen des Abwehrsystems (Monozyten und Makrophagen) zu binden und sich in diesen zu vermehren (Replikation). Durch die Virusvermehrung kommt es zum Zerfall der Fresszellen und die freiwerdenden Viruspartikel werden von anderen Fresszellen aufgenommen, wodurch sich das Virus im Körper ausbreitet. Durch die Abgabe von Zellbotenstoffen kommt es zur Aktivierung der die Blutgefäße auskleidenden Zellen (Endothelzellen) und damit zu einer Entzündung. Bestimmte Zellbotenstoffe führen auch zum Zelltod weiterer Abwehrzellen wie den Lymphozyten. Die nichtmutierte Variante vermehrt sich dagegen vorwiegend in den Darmepithelzellen des Leerdarms.[1]
Man nimmt heute an, dass ob und in welcher Form die Krankheit letztendlich auftritt, vom Immunstatus des Einzeltieres abhängig ist.
Bei einem Teil der Tiere bricht die Erkrankung trotz erfolgter Virusmutation aufgrund einer starken zellvermittelten Immunreaktion nicht aus. Das Immunsystem ist dadurch in der Lage, die infizierten Blutzellen unter Kontrolle zu halten. Diese Tiere bleiben ohne klinische Symptome, scheiden aber als latente Virusträger dieses weiter aus. Bei einem Teil der Tiere wird auch eine vollständige Viruselimination vermutet, wodurch sie allerdings für Neuinfektionen wieder empfänglich sind.
Klinisch manifest wird eine FIP vermutlich erst bei Störungen des Immunsystems, z. B. durch Stress oder andere Erkrankungen, die zu einer stärkeren Virusvermehrung im Darm führen. Einen Einfluss auf die Pathogenese hat die Bildung von Antikörpern, denn diese können das Virus nicht neutralisieren. Mit vermehrter Antikörperbildung werden auch vermehrt Makrophagen aktiviert, in denen es damit zu einer weiteren Virusvermehrung kommt. Das Paradoxon, dass die eigentlich zur Bekämpfung der Krankheitserreger gebildeten Antikörper zu einer Verschlimmerung der Krankheit führen („antikörperabhängige Verstärkung der Virusinfektion“, engl. antibody-dependent enhancement), wird auch bei Viruskrankheiten des Menschen (z. B. AIDS, Denguefieber) beobachtet. Dieses antibody-dependent enhancement spielt aber vermutlich nur bei experimentellen Infektionen eine Rolle.[1]
In der Vergangenheit wurde die Erkrankung in zwei Hauptformen („feuchte“ und „trockene Form“) untergliedert. Die Grenzen zwischen beiden Hauptformen sind jedoch fließend, nahezu jedes erkranktes Tier zeigt Komponenten beider Erscheinungsformen, von denen eine temporär dominieren kann. Daher wird diese Untergliederung in der neueren Literatur zunehmend als obsolet betrachtet.
„Feuchte Form“
Bei einer schwachen zellvermittelten Immunantwort kommt es zu einer anhaltenden Virusvermehrung im Blut (Virämie) und zur massiven Bildung von Immunkomplexen, zur Aktivierung des Komplementsystems und von Fresszellen (Makrophagen). Dies führt zu einer Blutgefäßentzündung (Vaskulitis) und zu einer lymphoplasmazellulären Perivaskulitis (durch Lymphozyten und Plasmazellen gekennzeichnete Entzündung in der Umgebung der Blutgefäße) der serösen Häute, die zu einem Gewebsuntergang (Nekrose) führt. Einige Autoren sind allerdings der Meinung, dass es sich bei den Veränderungen um eine echte granulomatöse Vaskulitis und Perivaskulitis, also eine durch Fresszellen dominierte Entzündung der Gefäße und deren Umgebung handelt[3]. Die lymphoplasmazelluläre Perivaskulitis stellt dann ein Spätstadium dar. Makroskopisch stellen sich diese Entzündungsherde als weißliche Knötchen dar. Durch die Entzündung kommt es auch zu einem Austritt von Serum und Proteinen in die Körperhöhlen und zu Fibrinablagerungen auf inneren Organen.
„Trockene Form“
Bei der „trockenen Form“ dominieren größere Knoten, die vorwiegend innerhalb der Organe entstehen. Es handelt sich dabei um verschmolzene Entzündungsherde, die wie bei der feuchten Form aus einer Vaskulitis/Perivaskulitis entstehen. Sie werden gelegentlich auch als „granulomatöse“ Veränderungen bezeichnet, es handelt sich aber nicht um eine echte granulomatöse Entzündung. Die Flüssigkeitsaustritte sind bei dieser Form nicht anzutreffen. Man nimmt an, dass sich diese Form bei einer weniger stark geschwächten zellvermittelten Immunantwort entwickelt und sie eine mildere, protrahierte Verlaufsform darstellt. Sie macht etwa 17 Prozent der FIP-Fälle aus, allerdings ist hier aufgrund der schweren Diagnostizierbarkeit (s. u.) mit einer erheblichen Dunkelziffer zu rechnen.
Symptome[B
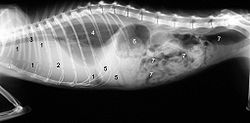
Eine klinisch manifeste FIP beginnt mit verminderter Futteraufnahme (Anorexie), Abmagerung sowie wiederkehrendem, therapieresistentem Fieber. Die weiteren Symptome sind von der Form der Ausprägung abhängig, wobei fließende Übergänge zwischen beiden Formen auftreten können. Die Unterteilung in feuchte und trockene Form ist strenggenommen eine Beschreibung der makroskopischen Befunde. Mikroskopisch bilden beide Formen meist ein identisches Bild aus.
„Feuchte Form“
Die klassische „feuchte Form“ äußert sich in Flüssigkeitsansammlungen in der Bauchhöhle (Bauchwassersucht, Ascites) und/oder Brusthöhle (Pleuraerguss). Die Flüssigkeitsansammlungen in der Bauchhöhle können als Umfangsvermehrung mit Fluktuation meist klinisch diagnostiziert werden. Flüssigkeitsansammlungen in der Brusthöhle können zu schwerer Atemnot führen. Eine Punktion liefert eine gelbliche, fadenziehende, viskose Flüssigkeit. Die Tatsache, dass es sich hierbei um ein proteinreiches Exsudat handelt, welches in seiner Erscheinungsform recht typisch ist, ist ein wesentliches diagnostisches Kriterium.
„Trockene Form“
Die „trockene Form“ äußert sich in knotigen Veränderungen, vor allem im Bauchraum. Auch das Gehirn, die Augen, die Organe der Brusthöhle oder lediglich die Haut können betroffen sein. Je nach Organlokalisation können Gelbsucht, Augenerkrankungen (Uveitis, Hornhautveränderungen [„Hammelfettpräzipitate“], Blutungen oder Fibrinansammlungen in der vorderen Augenkammer, Retinitis)[2], Blutarmut oder neurologische Erscheinungen (Krämpfe, Anfälle, Orientierungslosigkeit, Augenzittern, Lähmungen) auftreten.
Diagnose
Ein klinischer Anfangsverdacht ist bei jedem Fieber bei einer jüngeren Katze (jünger als sechs Jahre) gegeben, das nicht auf eine Antibiose anspricht.
Flüssigkeitsansammlungen in den Körperhöhlen („feuchte Form“) sowie ein vermehrter Gehalt an Globulinen im Blut (Hyperglobulinämie) sind bereits deutliche Indizien. Bestimmte Veränderungen des Blutbildes (mittlere bis schwere Anämie, Neutrophilie und Leukopenie) sind weitere Verdachtsmomente.
Folgende weiterführende diagnostische Testmethoden sind möglich:
- Rivalta-Probe: Durch eine Punktion wird Flüssigkeit aus einer betroffenen Körperhöhle entnommen. In einem Reagenzglas versetzt man destilliertes Wasser mit einem Tropfen Eisessig und gibt einen Tropfen des Punktats hinzu. Bei einer Infektion mit FIP löst sich der Tropfen nicht auf und sinkt nach unten. Ein negatives Testergebnis schließt eine FIP fast mit Sicherheit aus (Spezifität 98 Prozent), während ein positiver Test sie zwar wahrscheinlich macht, nicht aber beweist. Die Sensitivität beträgt nach neueren Untersuchungen nur 52 Prozent. Eine positive Rivaltaprobe kann auch bei eitriger Serositis und bei durch Tumoren bedingten Ergüssen auftreten.[1]
- Antikörpernachweis im Punktat: Der Nachweis von Antikörpern in den Punktaten mittels Antikörperfärbung hat eine Sensitivität und Spezifität von etwa 85 %.
- Antigennachweis in Makrophagen: Bei der feuchten Form kann aus dem Zentrifugat des Punktats ein Ausstrich angefertigt und mit einem Anti-Coronavirus-Konjugat versetzt werden. Die Sensitivität dieses Nachweisverfahrens wird je nach Studie mit 68–95 % angegeben. Die Spezifität wurde in der Literatur lange mit 100 % angegeben, eine aktuelle Studie lieferte jedoch drei falsch-positive Ergebnisse bei Katzen mit herzbedingtem Erguss (Spezifität 93 %).[4]
- Albumin-Globulin-Quotient: Die Bestimmung des Quotienten aus Albumin- und Globulin-Konzentration im Blut kann ebenfalls einen Hinweis auf die Erkrankung geben. Bei Quotienten kleiner als 1 besteht ein FIP-Verdacht, Werte unter 0,6 gelten als nahezu diagnostisch. Allerdings gibt es erhebliche Schwankungen hinsichtlich Sensitivität und Spezifität in Abhängigkeit von der Größe des Quotienten. Bei einem Quotienten von 0,9 liegt die Sensitivität bei 89 Prozent, die Spezifität bei 76 Prozent. Liegt der Wert unter 0,6, beträgt die Sensitivität nur noch 48 Prozent, die Spezifität hingegen bei 99 Prozent.
- Hohe Spiegel des Akute-Phase-Proteins saures Alpha1-Glykoprotein sind hinweisend für eine FIP.[2]
- Antikörpernachweis im Blut: Ein positiver indirekter Antikörpernachweis im Blut ist nicht eindeutig. Er sagt nur aus, dass die Katze mit dem Coronavirus Kontakt hatte, auch wenn es sich nur um die harmlose Variante handelte. Die Sensitivität liegt bei 85 Prozent, die Spezifität allerdings nur bei 57 Prozent. Ein positiver Test mit einem Titer von kleiner als 1:1600 erhöht zwar die Spezifität auf etwa 98 Prozent, reduziert allerdings die Sensitivität auf 33 Prozent.
- Antigen-Antikörper-Komplex-Nachweis im Blut: Der Nachweis von Antigen-Antikörper-Komplexen mittels ELISA hat nur eine Sensitivität von etwa 50 Prozent, die Spezifität liegt bei 91 Prozent.
- FCoV-RT-PCR: Über ein RT-PCR-Verfahren lässt sich eine Virämie nachweisen. Die Sensitivität liegt bei Untersuchung von Blut bei etwa 53 Prozent, die Spezifität bei 87,5 Prozent. Dieser Nachweis von Virus-RNA ermöglicht keine Unterscheidung zwischen harmlosen und mutierten Coronaviren. Bei der RT-PCR aus Ergussflüssigkeit sind Sensitivität und Spezifität dagegen hoch (> 90 %). Der Nachweis im Kot dient nur der Erkennung von Coronavirusauscheidern, für die Diagnose der Erkrankung ist er ungeeignet.[1]
Eine Kombination verschiedener Verfahren erhöht die diagnostische Aussagekraft. Eine Bestimmung der durch Hämolyse freigesetzten Lactatdehydrogenase (ein Enzym, das Laktat in Pyruvat umwandelt) kann einen weiteren Hinweis auf die Erkrankung geben, ebenso die die Bestimmung der bei Katzen meist durch FIP verursachten Erhöhung des Bauchspeicheldrüsenenzyms alpha-Amylase.
Während ein Antigennachweis im Erguss als beweisend gilt, ist die „trockene Form“ nur schwierig nachzuweisen. Die Nachweismethoden 4-8 sind ebenfalls möglich, allerdings gilt bislang nur der pathohistologische Nachweis als aussagekräftig für das Vorhandensein der FIP. Es gibt FIP-Katzen ohne jegliche Veränderungen dieser Parameter als auch Tiere, die trotz markanter Abweichungen dieser Parameter keine FIP haben.[2] Ein Nachweis der Antikörper in Gewebsproben (Bioptat) von Lunge, Leber, Niere und Lymphknoten gilt als beweisend, es gibt aber Kreuzreaktionen mit der harmlosen FCoV-Variante und anderen Coronaviren (Canines Coronavirus, TGE-Virus), für die Katzen zwar prinzipiell empfänglich sind, aber die keine FIP auslösen. Ein PCR-Virusnachweis in Geweben ist ebenfalls kommerziell erhältlich.
Seit 2012 gibt es eine Nachweismethode, die eine eindeutige molekularbiologische Charakterisierung der beiden Coronavirus-Varianten verspricht. Hierbei werden mittels PCR Mutationen in zwei Spike-Proteinen nachgewiesen, die mit der mutierten Variante und damit der FIP in direkter Beziehung stehen.[5] Dieser Test ist seit 2013 auch kommerziell verfügbar und kann an Punktaten von Ergüssen, Liquor cerebrospinalis und Kammerwasser sowie an EDTA-Blut erfolgen.[6]
Differentialdiagnose
Bei der recht typischen feuchten Form müssen andere Ursachen für eine Bauchwassersucht und/oder einen Pleuraerguss ausgeschlossen werden. Hierzu zählen vor allem eine Herzerkrankung, Proteinmangel im Blut (Hypoproteinämie), Stauungsergüsse durch Tumorerkrankungen, Blutungen oder eine bakterielle Pleuritis bzw. Peritonitis; seltener eine Streptotrichose (eitrige bakterielle Pleuritis, die Flüssigkeit ist hier aber bräunlich-trüb) oder eine Ruptur des Ductus thoracicus (Chylothorax). Ein Großteil dieser Erkrankungen kann aufgrund des hierdurch bedingten relativ geringen Proteingehaltes des Ergusses (Transsudat) sowie durch das Fehlen von Tumorzellen oder Bakterien recht einfach ausgeschlossen werden.
Bei therapieresistentem Fieber und/oder knotigen Veränderungen müssen Feline Leukämie, Immundefizienzsyndrom der Katzen, Panleukopenie, Lymphosarkome, Yersiniose und die Tyzzersche Krankheit in Betracht gezogen werden.
Therapie und Prophylaxe
Eine klinisch manifeste FIP führt unweigerlich binnen weniger Wochen zum Tod, da es noch keine Behandlungsmöglichkeit gibt. Lediglich eine symptomatische Therapie kombiniert mit einer Immunsuppression ist möglich. Hinweise, dass sich eine zusätzlich zur immunsuppressiven Therapie durchgeführte Behandlung mit felinem Interferon vorteilhaft auf die Überlebenszeit auswirken kann, konnten in einer aktuellen Studie nicht bestätigt werden.[7] Ein Therapieversuch kann mit hochdosierten Glucocorticoiden, eventuell in Kombination mit dem Thromboxansynthase-Inhibitor Ozagrel unternommen werden. Gegen bakterielle Sekundärinfektionen ist ein Antibiotikum angezeigt.
Die Impfung gegen FIP wird kontrovers diskutiert. Prinzipielles Problem ist hierbei, dass eine systemisch applizierte Vakzine (Impfstoff) bei den verwendeten Stämmen die Gefahr der Entstehung einer FIP durch das Impfvirus in sich birgt, das Impfvirus mit dem Feldvirus vermengt werden kann und eine antikörperabhängige Immunverstärkung auftreten kann. Das Ziel des verfügbaren Impfstoffes ist daher die Erzeugung einer lokalen Immunantwort auf zellulärer Ebene und auf Basis von lokalem IgA im Bereich der Eintrittspforte der Viren im Nasen-Rachenbereich. Daher wird die Vakzine in die Nase eingetropft. Die lediglich lokale Wirkung der Vakzine ist hierbei dadurch gewährleistet, da sich der Impfstamm nur bei einer Temperatur von 31 °C vermehren kann. Bei bereits FCoV-positiven Tieren (auch durch die harmlose Variante) versagt das Prinzip der Impfung. Sie ist daher nur bedingt zu empfehlen. Sinnvoll ist sie bei seronegativen Katzen in größeren Beständen sowie einzeln in Wohnungen gehaltenen Tieren, die durch zufälligen Kontakt mit eingeschlepptem Virusmaterial (z. B. Kot an den Schuhen der Besitzer) infolge des massiven „Virusloads“ in ihrer Immunantwort überfordert wären. Die Schutzwirkung des Impfstoffs (Primucell FIP®) erbrachte in klinischen Studien sehr unterschiedliche Resultate. Je nach Studie wurde eine Effizienz zwischen 0 (für keine Schutzwirkung) und 75 Prozent angegeben.
Den Versuch, die Ausbreitung der harmlosen Ausgangsvariante des Virus zu verhindern, verfolgt das Konzept des „Early Weaning“ (engl., frühes Absetzen), das 1992 von Addie & Jarrett vorgestellt wurde. Hierbei wird die trächtige Mutterkatze zwei Wochen vor der Geburt von anderen Katzen isoliert und die Geburt und Jungkatzenaufzucht strikten Hygienebedingungen unterworfen. Mit fünf bis sechs Wochen werden die Kätzchen von der Mutter abgesetzt und von ihr getrennt, weil sie nur bis zu diesem Zeitpunkt durch mütterliche Antikörper geschützt sind und danach von ihr das Virus übertragen bekommen könnten. Im Gegensatz zu Erfolgen in Großbritannien, bei denen alle Jungkatzen anschließend FCoV-seronegativ waren, ließ sich dieses Resultat in einer deutschen Studie nicht reproduzieren.
Eine praktikablere Strategie besteht in der Verminderung des Infektionsdruckes innerhalb des Katzenbestandes. Das Prinzip besteht darin, die potentiell krankmachenden FCoV-Viren lediglich so weit wie möglich auszudünnen und ist mit einfachen hygienischen Methoden bereits durchführbar. Als mögliche Maßnahmen werden empfohlen:
- Aufstellen möglichst vieler Kotkisten, welche mehrmals täglich gereinigt werden sollten
- wenn möglich Verwendung immer der gleichen Trink- und Futtergefäße und deren tägliche Reinigung
- Haltung der Katzen in Kleingruppen von 3 bis 4 Tieren
- Entfernung von starken Virusausscheidern aus der Gruppe
- Muttertiere 2 Wochen vor dem Wurf aus der Gruppe entfernen und separate Aufzucht der Jungtiere.
Giardien
| Giardien | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
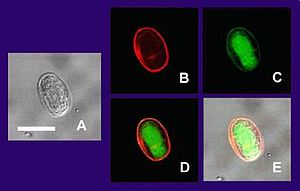
Verschiedene Ansichten einer Giardia-Cyste |
||||||||||||
| Systematik | ||||||||||||
|
||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Giardia | ||||||||||||
| Künstler 1882 |
Giardien (Giardia) sind eine Gattung von mikroskopisch kleinen Dünndarm-Parasiten. Sie werden, ähnlich wie Kokzidien, traditionell zu den Protozoen gezählt, d. h. es sind heterotrophe Einzeller. Sie kommen weltweit bei einer Vielzahl von Säugetieren, aber auch bei Amphibien, Reptilien und Vögeln vor. Für den Menschen stellen sie als Zoonoseerreger eine Gefahr dar. Ein weit verbreiteter Vertreter der Giardien ist Giardia intestinalis, auch Giardia lamblia oder Giardia duodenalis genannt, der Vögel und Säugetiere befällt. Giardia agilis kommt bei Reptilien vor, Giardia muris bei Nagetieren und Vögeln.[1]
Die Darmparasiten haben eine birnenförmige Gestalt mit zwei typischen Kernen, die den Anschein eines Augenpaares (in Wirklichkeit Zellkerne mit Erbinformationen) haben. Zur Fortbewegung nutzen Giardien ihre Geißeln. Mit Hilfe ihrer Bauchhaftscheibe sind die Durchfallerreger in der Lage, sich an der Darmwand des Wirts festzusetzen, d. h. sie dringen nicht in das Gewebe ein. Dort vermehren sie sich dann millionenfach auf der Oberfläche der Darmschleimhaut.
Um andere Lebewesen (u. a. auch Menschen) zu befallen, umgeben sich jeweils zwei Giardien mit einer schützenden Hülle und lassen sich über den Kot ausscheiden. Durch die Hülle sind sie tage- bis wochenlang geschützt, bevor sie vom neuen Wirt über verschmutztes Wasser oder Nahrungsmittel aufgenommen werden. Die infektiösen Parasiten bleiben in feuchten Böden bis zu sieben Wochen infektiös, in kühlem Wasser (4 °C) bis zu drei Monaten, wobei sie unter optimalen Bedingungen sogar mehrere Monate lebensfähig bleiben können.
Viele Menschen und Tiere beherbergen Giardien im Darm, ohne sich krank zu fühlen. Trotzdem scheiden sie den Parasiten mit ihrem Stuhl aus. Andere befallene Individuen leiden an Übelkeit, Bauchschmerzen und Durchfall. Beim Menschen findet eine Infektion mit Giardien meist während einer Reise in tropische Regionen oder Abenteuerreisen in die freie Natur statt. Tatsächlich sind die hygienischen Bedingungen in diesen Gebieten oder „Camps“ oft ungenügend, sodass eine Ansteckung durch Wasser oder Nahrungsmittel leicht möglich ist.
Giardien stellen ein Problem in der Trinkwasseraufbereitung dar, sie lassen sich weder durch Chlor noch durch Ultraviolettstrahlung komplett abtöten. Aus diesem Grund wird zur Oberflächenwasser-Aufbereitung häufig Ultrafiltration eingesetzt, um sie abzufiltrieren.







